Chimioterapia IPT
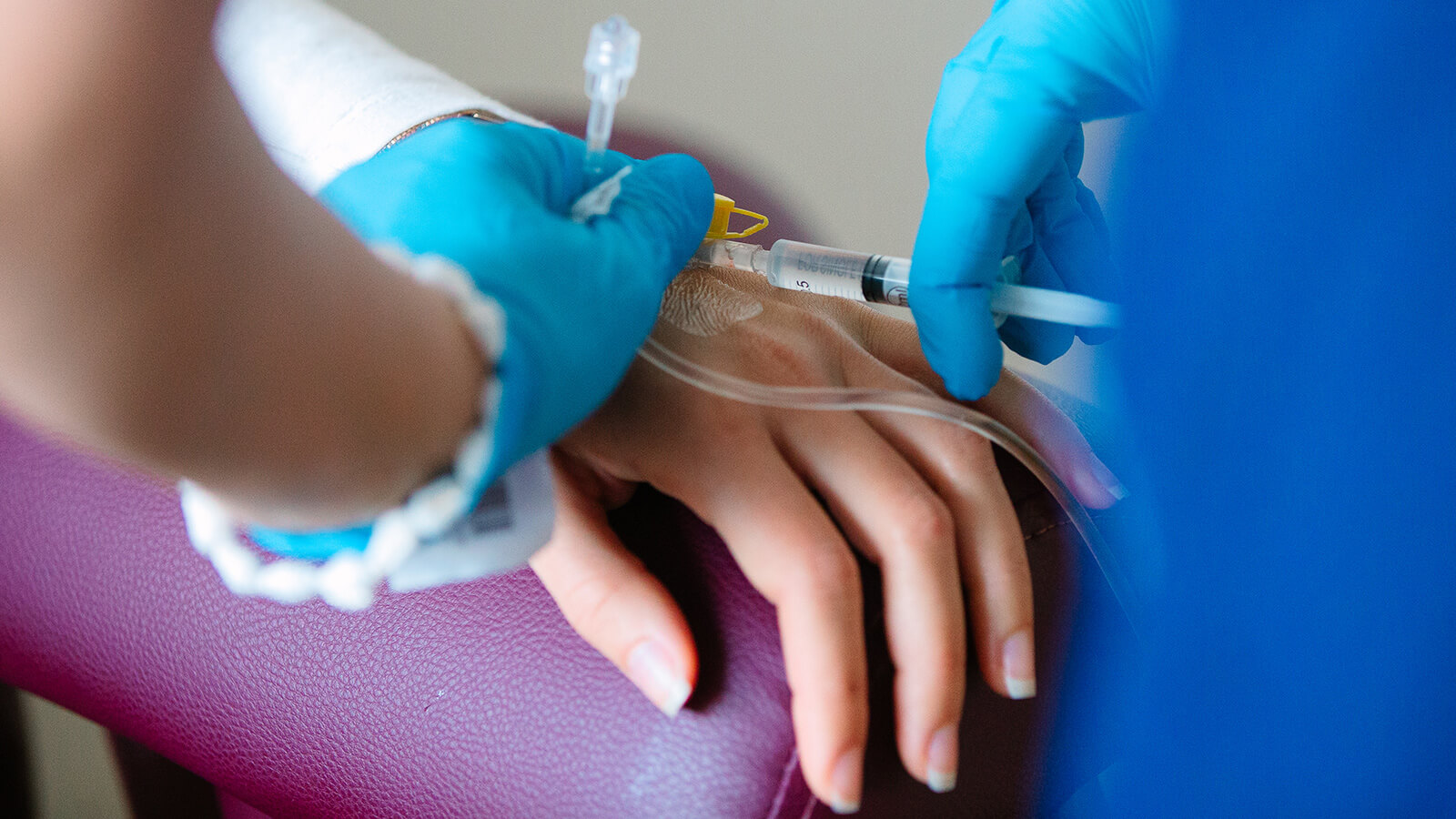
Chimioterapia Potențată cu Insulină (IPT) este o terapie care, în oncologie, poate fi combinată cu chimioterapia convențională. Pentru chimioterapia potențată cu insulină (IPT) se folosește însă o cantitate mai redusă de citostatic, deoarece este amplificată absorbția citostaticului de către celula tumorală prin administrarea de insulină înaintea perfuzării citostaticului.
Chimioterapia Potențată cu Insulină (IPT) este recomandată mai ales pentru persoanele cu un status imun sau biologic scăzut ce nu permite abordarea cu dozele maxime admise din chimioterapia convențională.
Avantajul este că efectele adverse sunt minimalizate, astfel încât administrarea terapiei poate fi făcută mai des, fără a fi afectate celulele sănătoase.
Mecanismul de bază
folosit în această
abordare
Este legat de capacitatea insulinei de a permeabiliza membrana celulară în favoarea absorbției nutrienților necesari hrănirii celulei. Nivelele mici de insulină produsă de pancreas sunt asociate cu nivele crescute de glucoză în sânge, căci celulelor le este imposibil să o acceseze, atât timp cât canalele membranei celulare sunt închise. De asemenea, nivelele mari de insulină scad glucoza din sânge, deoarece crește absorbția celulară a acesteia.
Studiile au arătat însă că permeabilizarea membranelor celulare, în urma creșterii nivelului de insulină, va favoriza nu numai absorbția nutrienților, ci și a medicamentelor prezente în sânge. Astfel, s-a născut ideea folosirii insulinei în cancer, practic chimioterapia potențată cu insulină (IPT).
Se știe că celula tumorală are nevoie de mult mai multe resurse decât celula normală pentru a rămâne viabilă și a se înmulți, determinând progresia cancerului.
În felul acesta, în funcție de tipul de cancer, celula tumorală absoarbe până la de 20 ori mai mulți nutrienți decât celula normală, iar, în acest scop, posedă de 5-15 ori mai mulți receptori de insulină pe membrana celulei.
Un factor esențial în supraviețuirea tumorii canceroase este glucoza. De aceea, prin administrarea unei cantități mici de insulină și scăderea nivelului de glucoză, celula tumorală își va deschide larg porțile membranei celulare.
Înfometată, dar în același timp incapabilă să-și satisfacă nevoile de glucoză, celula tumorală va fi mult mai susceptibilă la absorbția citostaticului, care este administrat chiar în acea fereastră de oportunitate, când glucoza în sânge este mai scăzută.
Cantitatea de citostatic absorbită în cadrul chimioterapiei potențate cu insulină (IPT) fiind mult mai crescută există posibilitatea micșorării dozelor, dar și a reluării terapiei la un interval mai scurt de timp în comparație cu chimioterapia obișnuită, fără a fi afectate organele sau sistemul imunitar.
Un avantaj al administrării mai frecvente este acela că celulele tumorale nu mai au timpul necesar pentru a se regenera și înmulți, iar terapia își atinge mai ușor obiectivul.
Din punctul de vedere al cercetărilor desfășurate până în prezent, mecanismele care stau la baza chimioterapiei IPT sunt următoarele:
Administrarea insulinei amplifică capacitatea de absorbție a citostaticului
Absorbția este amplificată proporțional cu numărul de receptori de insulină, de 6-15 ori mai mare decât la o celulă normală 1. Insulina, legându-se de receptorul membranei celulare de insulină, internalizează un semnal de endocitoză mediat de clarhirin 2. Endocitoza însă reprezintă unul din mecanismele absorbției celulare a chimioterapicelor 3. Așadar, o cantitate mai mare de citostatic va pătrunde în celulă, chiar în condițiile unui nivel plasmatic al citostaticului mult mai redus.
Administrarea insulinei crește oxigenarea celulei tumoralecu efect pozitiv în radioterapie și chimioterapie
Studiile realizate privind sensibilizarea tumorilor la radioterapie au scos în evidență faptul că insulina crește semnificativ oxigenarea tumorală de la 0–3 mm Hg la 8–11 mm Hg 4. Având în vedere că citostaticele, la fel ca radioterapia, acționează mult mai bine în prezența oxigenului, acest mecanism va favoriza efectul citotoxic al chimioterpiei.
Administrarea insulinei conduce la trecerea celulelor tumorale din faza G în faza S 5
Creșterea ratei proliferării prin introducerea în faza S sensibilizează celulele tumorale la citostatic, deoarece citostaticele atacă în cele mai multe cazuri celulele aflate în această fază de proliferare.
Studiile demonstrează amplificarea efectului chimioterapiei la administrarea insulinei
Astfel, insulina crește răspunsul la 5-fluorouracil și cyclophosphamide 6, vinorelbine și mafosfamide 7 în celulele cancerului de sân. Tot în cancerul de sân, un studiu clinic realizat pe un grup de femei care erau rezistente la mai multe citostatice, s-a constatat o potențare a metotrexatului de către insulină cu un efect în stabilitatea bolii 8. Îmbunătățește efectul citotoxic al 5-fluorouracil în cancerul esofagian și de colon 9. Crește semnificativ efectul paclitaxelului în cancerul endometrial 10. Crește sensibilitatea celulelor tumorale de choriocarcinoma rezistente la 5-fluorouracil 11. Îmbunătățește efectul citostaticelor 5-fluorouracil, oxaliplatin, irinotecan, cyclophosphamide și docetaxel în cancerul de colon 12. Insulina crește apoptoza generată de cisplatin în cancerul scuamos esofageal 13 14.
Bibliografie
2. Hall, Catherine, Hongtao Yu, and Eunhee Choi. "Insulin receptor endocytosis in the pathophysiology of insulin resistance." Experimental & molecular medicine 52.6 (2020): 911-920; Hunker, C. M., et al. "Role of Rab5 in insulin receptor-mediated endocytosis and signaling." Archives of biochemistry and biophysics 449.1-2 (2006): 130-142.
4. Jordan, Bénédicte F., et al. "Insulin increases the sensitivity of tumors to irradiation: involvement of an increase in tumor oxygenation mediated by a nitric oxide-dependent decrease of the tumor cells oxygen consumption." Cancer research 62.12 (2002): 3555-3561; Jordan, Bénédicte F., et al. "Preclinical safety and antitumor efficacy of insulin combined with irradiation." Radiotherapy and oncology 81.1 (2006): 112-117.
2. Hall, Catherine, Hongtao Yu, and Eunhee Choi. "Insulin receptor endocytosis in the pathophysiology of insulin resistance." Experimental & molecular medicine 52.6 (2020): 911-920; Hunker, C. M., et al. "Role of Rab5 in insulin receptor-mediated endocytosis and signaling." Archives of biochemistry and biophysics 449.1-2 (2006): 130-142.
3. Muley, Helena, et al. "Drug uptake-based chemoresistance in breast cancer treatment." Biochemical Pharmacology 177 (2020): 113959; Muley, Helena, et al. "Drug uptake-based chemoresistance in breast cancer treatment." Biochemical Pharmacology 177 (2020): 113959.
4. Jordan, Bénédicte F., et al. "Insulin increases the sensitivity of tumors to irradiation: involvement of an increase in tumor oxygenation mediated by a nitric oxide-dependent decrease of the tumor cells oxygen consumption." Cancer research 62.12 (2002): 3555-3561; Jordan, Bénédicte F., et al. "Preclinical safety and antitumor efficacy of insulin combined with irradiation." Radiotherapy and oncology 81.1 (2006): 112-117.
5. Gross, Gary E., David H. Boldt, and C. Kent Osborne. "Perturbation by insulin of human breast cancer cell cycle kinetics." Cancer research 44.8 (1984): 3570-3575; Sha, Huilan, et al. "Insulin in endometrial carcinoma chemotherapy: A beneficial addition and not a problem." Journal of Huazhong University of Science and Technology [Medical Sciences] 30.5 (2010): 631-637.
6. Agrawal, Siddarth, et al. "Insulin-induced enhancement of MCF-7 breast cancer cell response to 5-fluorouracil and cyclophosphamide." Tumor Biology 39.6 (2017): 1010428317702901.
8. Lasalvia-Prisco, Eduardo, et al. "Insulin-induced enhancement of antitumoral response to methotrexate in breast cancer patients." Cancer chemotherapy and pharmacology 53.3 (2004): 220-224.
9. Zou, Ke, Ji‐hang JU, and Hong Xie. "Pretreatment with insulin enhances anticancer functions of 5‐fluorou‐racil in human esophageal and colonic cancer cells." Acta pharmacologica sinica 28.5 (2007): 721-730.
10. Sha, Huilan, et al. "Insulin in endometrial carcinoma chemotherapy: A beneficial addition and not a problem." Journal of Huazhong University of Science and Technology [Medical Sciences] 30.5 (2010): 631-637.
11. Shan, Ying, et al. "Insulin reverses choriocarcinoma 5-fluorouracil resistance." Bioengineered 12.1 (2021): 2087-2094.
12. Agrawal, Siddarth, et al. "Insulin enhancement of the antitumor activity of chemotherapeutic agents in colorectal cancer is linked with downregulating PIK3CA and GRB2." Scientific reports 9.1 (2019): 1-14.
13. Yang, Yang, et al. "Insulin enhances apoptosis induced by cisplatin in human esophageal squamous cell carcinoma EC9706 cells related to inhibition of autophagy." Chinese Medical Journal 127.02 (2014): 353-358.
14. Damyanov, Christo, et al. "Low-dose chemotherapy with insulin (insulin potentiation therapy) in combination with hormone therapy for treatment of castration-resistant prostate cancer." International Scholarly Research Notices 2012 (2012).
Soluțiile terapeutice adoptate în clinica ImunoMedica
Au în vedere o gamă largă de terapii convenționale, adjuvante și suportive, în care sunt integrate concepte medicale confirmate printr-o temeinică cercetare științifică, dar și prin experiența clinică a numeroși specialiști în domeniul cancerului din întreaga lume.
Pacienții ImunoMedica au acces la cele mai noi tehnologii și inovații în domeniul diagnosticului și al tratamentelor, din momentul în care acestea și-au dovedit utilitatea, eficiența și siguranța.